Definição:
Função Química é portanto o grupo de compostos que embora diferentes,possuem propriedades químicas semelhantes.
Principais funções químicas inorgânicas: ácidos,bases,sais e óxidos.
Ácidos Segundo Arrheunius,é toda substância que em solução aquosa se ionizam formando um cation chamado Hidrogênio ionizavel (H+) (ou H3O+ .
1.Ionização - reação entre moléculas que levará a produção de ions .
Alguns tipos de função ácido
A: HCl Cloreto de Hidrogênio
Quando ocorre sua dissolução na água, há a produção de ácidos clorídrico.
HCl(gás) Cloreto de Hidrogênio
HCl (aquoso) Ácido Clorídrico
B: H2SO4 Sulfato de Hidrogênio
Trata-se de um composto corrosivo que na presença de água reage violentamente produzindo ácido sulfúrico.
H2SO4 Sulfato de Hidrogénio
quando H2SO4 for (aquoso) ele vai ser - ácido Sulfúrico
As formulas são usadas tanto para ácidos como para os compostos que lhe dão origem.
-- Formula geral
HxE Ou HxEgO3
Ex: H2S Ex: H2cO3
Propriedades
- Sabor azedo - Conduz em solução aquosa mudam de cor
- Entram em contato com o bicarbonato de sódio provoca efervecencia.
- Reagem com bases formando água e sal.
monoácido.....................................1hidrogênio
diácidos...........................................2 hidrogênio
triacidos...........................................3 hidrogênios
tretacidos..........................................4 hidrogênio
Classificação
A- De acordo com o numero de elementos químicos.
Binário
ex: HBr
Tenario
ex: H3PO4
Quaternário
ex: H4Fe(CN)6
B-Quanto a presença de oxigênio
Hidróxidos - quando não tem oxigênio; Ex:HCN
Oxiácidos - quando tem oxigênio;
C- Quanto a volatividade
volatividade vem da palavra volátil
volátil: atomicidade (< 7) Ex: H2S
2+1=3
Fixo atomicidade (> 7) Ex:H3PO4
3+1+4=8
D- Quanto atomicidade ou grau de ionização
HIdrácidos- Forte :HI,HBr e HCl
Moderado :Hf
Fraca : Os demais
Oxiácidos - Fraco : 2 ou 3 Ex:H2SO4
Moderado : 1 Ex:H2 PO4
Fraco : 0
Nomes dos ânios
ácidos ânions
ídrico eto
oso ito
ico ato
Bases
É toda substância,que em solução aquosa,que libera como ânions chamado hidróxila ou oxidrila (OH-).
Nomes
Dá- se nome aos compostos que se originam delas.
Exemplo: M(OH)m - hidróxido de metal
Basta colocar o nome do metal em frente á expressão hidróxido.
Exemplo:
KOH - Hidróxido de Potássio
Fe(OH)2 - Hidroxido de Ferro II
Obs: Alguns elementos formam mais de um cátion e,por isso,deve-se representar com algarismo romano a valência do cátion.
Não se indica Nox fixo do metal no nome de seu hidróxido.
Nomes dados oas óxidos
Regra geral:
mono
di óxido de (nome do elemento)
tri
tetra
penta
hex
hept
Oxigênio com Nox igual a -2 e o elemento com Nox fixo
óxido + nome do elemento
Solubilidade dos hidróxdos em água
Hidróxidos dos alcalinos - muito solúveis metal familia 1A e 2A
Totalmente solúveis → bases de metais alcalinos (1A) e o hidróxido de amônio (NH4OH).
Parcialmente solúveis → bases de metais alcalinos terrosos (2A).
Praticamente insolúveis → bases dos demais metais.
Exceção: O Be(OH)2 e Mg(OH)2 (bases da família 2A) são praticamente insolúveis.
CLASSIFICAÇÃO DAS BASES
Quanto ao número de hidroxilas na fórmula da base
Dibase → duas hidroxilas na fórmula da base.
Ex.: Ca(OH)2, Mg(OH)2, Zn(OH)2
Tribase → três hidroxilas na fórmula da base.
Ex.: Al(OH)3, Fe(OH)3, Mn(OH)3
Tetrabase → quatro hidroxilas na fórmula da base.
Ex.: Mn(OH)4, Sn(OH)4, Pb(OH)24
Quanto ao grau de dissociação (força das bases) Para que uma base se dissocie é necessário que esta base esteja dissolvida em água, com isso teremos:
É todo composto binário cujo elemento mais eletronegativo é o oxigênio.
A exceção é o fluor- único elemento mais eletronegativo que o xoigênio formando o composto (Floreto de oxigênio) que não é óxido.
Bases fortes → bases dos metais da família 1A e 2A.
Bases fracas → bases dos demais metais, Be(OH)2, Mg(OH)2 e NH4OH.
Exceção: O hidróxido de amônio (NH4OH) é uma base solúvel, mas que apresenta um pequeno grau de ionização, desta forma, esta base é classificada como solúvel e fraca.
Óxido
Óxidos são compostos binários em que o elemento oxigênio apresenta número de oxidação igual a -2 e é o mais eletronegativo da fórmula tornado-o o mais potente elemento.
As propriedades de um óxido dependem das características esperticunstulares do elemento formador.
Classificação dos óxidos
| classificação | formadores | exemplos |
|---|---|---|
| básicos | metais com nox +1 ou +2 e do grupo 1A e 2A | CaO, FeO, K2O |
| ácidos ou anidridos | metais com nox +5, +6 e +7 e ametais com qualquer nox, exceto C+2, N+1 e N+2 | SO3, Cl2O, Mn2O7 |
| neutros | C+2, N+1 e N+2 | NO, CO, N2O |
| anfóteros | Os mais comuns são formados pelos metais Al, Mn, Zn, Pb e Sn | Al2O3, MnO2, ZnO, PbO, SnO |
| salinos, mistos ou duplos | metais com nox médio +8/3 | Pb3O4, Fe3O3 |
Obs: os óxidos anfóteros se comportam como óxidos básicos na presença de ácidos e como óxidos ácidos na presença de bases.
Obs: os óxidos mistos são a "soma" dos óxidos formados por um elemento, ou seja, é uma nuvem com todos os tipos de óxidos desse elemento:
- FeO + Fe2O3 → Fe3O4
Nomenclatura dos óxidos
a) para qualquer óxido- prefixo + óxido de + prefixo + elemento
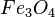 = tetróxido de triferro
= tetróxido de triferro
 = trióxido de dinitrogênio
= trióxido de dinitrogênio
- óxido de + elemento
 - óxido de sódio
- óxido de sódio
 - óxido de alumínio
- óxido de alumínio
- óxido + elemento + sufixo OU óxido de + elemento + nox em algarismo romano
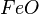 = óxido ferroso ou óxido de ferro II
= óxido ferroso ou óxido de ferro II
 = óxido férrico ou óxido de ferro III
= óxido férrico ou óxido de ferro III
- anidrido + prefixo + elemento + sufixo
| nox | prefixo | sufixo |
|---|---|---|
| +1 ou +2 | hipo | oso |
| +3 ou +4 | - | oso |
| +5 ou +6 | - | ico |
| +7 | (hi)per | ico |
Exceções: para os elementos B+3, C+4 e Si+4 só se usa o sufixo "ico".
Exemplos:
 = anidrido carbônico
= anidrido carbônico
 = anidrido permangânico
= anidrido permangânico
Nomenclatura dos peróxidos
- peróxido de + elemento
Nomenclatura dos superóxidos
- superóxido de + elemento
Sais
Sais são compostos que em meio aquoso se dissociam, liberando pelo menos um cátion diferente de
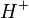 e pelo menos um ânion diferente de
e pelo menos um ânion diferente de  . São definidos, muito limitadamente, como compostos binários resultante da reação de um ácido e uma base.
. São definidos, muito limitadamente, como compostos binários resultante da reação de um ácido e uma base.Obs: Quando dissolvidos em água, seus íons dissociados ganham mobilidade e se tornam condutores de eletricidade
Obs2: Como os sais são essencialmente iônicos
Classificação dos sais
a) de acordo com a presença de oxigênio- Sais halóides: não possuem oxigênio
- Exemplos:
 ,
, 
- Exemplos:
- Oxissais: possuem oxigênio
- Exemplos:
 ,
, 
- Exemplos:
- Sal normal: é formado pela neutralização completa entre um ácido e uma base. Não possui nem H+ nem OH-
- Exemplo:

- Exemplo:
- Hidrogenossal ou hidroxissal: é formado numa reação de neutralização quando o ácido e a base não estão em proporção estequiométrica. Sendo assim, há uma neutralização parcial, sobrando H+ ou OH-
- Exemplo (hidrogenossal):

- Exemplo (hidroxissal):
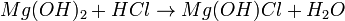
- Exemplo (hidrogenossal):
- Sal misto: o sal apresenta em sua fórmula mais de um cátion ou mais de um ãnion diferentes. É formado a partir da neutralização de um ácido por mais de uma base ou de uma base por mais de um ácido.
- Exemplo:

- Exemplo:
Nomenclatura dos sais
a) para sais halóides- ametal + eto de cátion
b) para oxissais
Usamos uma extensão da tabela de óxidos ácidos e oxiácidos, pois a nomenclatura dos oxissais também depende do nox.
| - | - | óxidos ácidos e oxiácidos | oxissais |
|---|---|---|---|
| nox | prefixo | sufixo | sufixo |
| +1 ou +2 | hipo | oso | ito |
| +3 ou +4 | - | oso | ito |
| +5 ou +6 | - | ico | ato |
| +7 | (hi)per | ico | ato |
Exceções: Como os elementos B+3, C+4 e Si+4 só possuem sufixo "ico" na forma de ácido, quando sais, usa-se sempre o sufixo "ato".
Exemplos:
 (nox N = +3) = nitrito de potássio
(nox N = +3) = nitrito de potássio
 (nox Cl = +1) = hipoclorito de sódio
(nox Cl = +1) = hipoclorito de sódio
 (nox Mn = +7) = permanganato de potássio
(nox Mn = +7) = permanganato de potássio
Monobase → uma hidroxila na fórmula da base.
Ex.: NaOH, KOH, AgOH
Efeito estufa e os óxidos

O lançamento de gases na atmosfera intensifica o efeito estufa
O efeito estufa é a retenção da maior parte de radiação solar pela atmosfera fazendo com que a superfície terrestre seja aquecida. A retenção da radiação solar ocorre por causa dos gases que estão presentes na atmosfera, como é o caso do Dióxido de Carbono, Metano, Clorofluorcarbonos, Óxido Nitroso, Óxidos de Azoto e Ozônio.
O principal gás responsável pelo efeito estufa é o dióxido de carbono liberado na atmosfera através da utilização de combustíveis fósseis e da destruição das florestas. Outro gás que se destaca é o metano, pois agride 20% a mais que o dióxido de carbono e é produzido pelas flatulências dos bovinos.
Tais lançamentos de gases se não controlados irão desestruturar o equilíbrio energético e ecológico do planeta, pois o chamado aquecimento global já é fato. O aquecimento global é o aumento da temperatura dos oceanos e do ar que resultam de causas naturais ou/e antropogênicas, ou seja, provocadas pelo homem.
Nos últimos anos, a temperatura do planeta aumentou em 0,5ºC o que parece pouco, mas que representa grande adaptação para todo ser vivo. A grande quantidade de poluição atmosférica tem contribuído consideravelmente para tal aumento e conseqüente desequilíbrio e se não controlado pode chegar a extinguir inúmeras espécies marinhas, residentes em geleiras e ainda plantas e outros.
O aumento da temperatura a princípio derreteria todas as calotas polares fazendo com que o nível dos oceanos se elevasse e inundasse conseqüentemente inúmeros países ou quem sabe até continentes. Além disso, o efeito estufa também pode colaborar com a proliferação de doenças.
O principal gás responsável pelo efeito estufa é o dióxido de carbono liberado na atmosfera através da utilização de combustíveis fósseis e da destruição das florestas. Outro gás que se destaca é o metano, pois agride 20% a mais que o dióxido de carbono e é produzido pelas flatulências dos bovinos.
Tais lançamentos de gases se não controlados irão desestruturar o equilíbrio energético e ecológico do planeta, pois o chamado aquecimento global já é fato. O aquecimento global é o aumento da temperatura dos oceanos e do ar que resultam de causas naturais ou/e antropogênicas, ou seja, provocadas pelo homem.
Nos últimos anos, a temperatura do planeta aumentou em 0,5ºC o que parece pouco, mas que representa grande adaptação para todo ser vivo. A grande quantidade de poluição atmosférica tem contribuído consideravelmente para tal aumento e conseqüente desequilíbrio e se não controlado pode chegar a extinguir inúmeras espécies marinhas, residentes em geleiras e ainda plantas e outros.
O aumento da temperatura a princípio derreteria todas as calotas polares fazendo com que o nível dos oceanos se elevasse e inundasse conseqüentemente inúmeros países ou quem sabe até continentes. Além disso, o efeito estufa também pode colaborar com a proliferação de doenças.
Poluentes capazes de gerar chuva ácida

*Impactos ambientais causados pela poluição do ar:a poluição do ar atmosférico causa muitos impactos ambientais ,tanto em escala local e regional,destacam-se a inversão térmica , as ilhas de calor e a chuva acida.
Em escala global (efeito estufa) e a destruição da camada de ozônio.
CHUVA ÁCIDA:
A água da chuva acida é normalmente ácida.Porém, a presença de poluentes no ar atmosférico (acido sulfúrico, ácido clorídrico, trióxido de nitrogênio) torna a água da chuva mais acida ainda.
As regiões desenvolvidas do hemisfério norte, com muitas industrias, grandes cidades e, conseqüentemente, grandes emissores de poluentes,são as mais afetadas pela chuva ácida..Alguns lugares da América do norte, Europa e Japão apresentam índices de acidez muito altos.
Entretanto, os efeitos da chuva ácida atingem lugares situados a centenas de qui8lometros das fontes poluidoras.rios lagos , solos atingidos pela chuva acida tem sua acidez aumentada.os solos podem perder nutrientes ,como,potássio, cálcio.e magnésio,com sérios danos para a vegetação.
curiosidades

 =
= 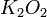
 =
=  =
=  =
=
Bom dia garotas aqui estão voceis com novas postagens os assuntos estão muitos bons da pra estudar bem pra aqueles que gostam de estudar pela internet é bom e aqueles que não gostam vão ter que começar a gostar.
ResponderExcluirBeijo ate mais
oi meninas este blog de voces é muito bom espero que voces continuem fazendo novas postagens para ajudar aquelas pessoas que tenham dificuldades em quimica e para aquelas pessoas que gostam de estudar.
ResponderExcluirparabens!