calculos estequiometricos
A palavra estequiometria (ou equações químicas) vem do grego stoikheion (elemento) e metriā (medida, de metron). A obra Stoichiometria de Nicéforo rendeu muitas linhas nos livros canônicos do Novo Testamento e dos Apócrifos. O termo "estequiométrico" é usado com frequência em Termodinâmica para referir-se à "mistura perfeita" de um combustível e o ar.
A estequiometria baseia-se na lei da conservação das massas e na lei das proporções definidas (ou lei da composição constante), e na lei das proporções múltiplas. Em geral, as reações químicas combinam proporções definidas de compostos químicos. Já que a matéria não pode ser criada ou destruída, a quantia de cada elemento deve ser a mesma antes, durante e após a reação. Por exemplo, a quantia de um elemento A no reagente deve ser igual à quantia do mesmo elemento no produto.
A estequiometria é usada frequentemente para balancear equações químicas. Por exemplo, os dois gases diatômicos hidrogênio e oxigênio podem combinar-se para formar um líquido, água, em uma reação exotérmica, como descrita na Equação [1].
 [1]
[1]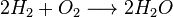 [2]
[2]O termo "estequiometria" também é usado com frequência para as proporções molares de elementos em compostos estequiométricos. Por exemplo, a estequiometria do hidrogênio e do oxigênio na água (H2O) é 2:1. Em compostos estequiométricos, as proporções molares são números inteiros (e é aí que está a lei de proporções múltiplas). Compostos cujas proporções molares não são números inteiros são chamados de compostos não-estequiométricos.
A estequiometria não é tão somente usada para balancear equações químicas, mas também para conversões de unidades - por exemplo, de gramas a mols, ou gramas a mililitros. Por exemplo, se temos 2,00 g de NaCl, para achar o número de mols, pode-se fazer o seguinte:


- Quantos gramas de alumínio são necessários para reagir completamente com 85 g de óxido de ferro III?
- Resposta: 28,6875 g de alumínio.
- Num laboratório de química há duas soluções, a primeira é de ácido sulfúrico (H2SO4) com concentração desconhecida, a segunda é de soda cáustica (NaOH) em concentração de 0,10 mol/L. Sabe-se que 25 mL da solução de ácido exigem 22,50 mL da solução de soda cáustica para ser neutralizada completamente. Com base nessas informações, pede-se que se calcule a concentração de ácido na solução.
- Resolução
- Começa-se montando uma regra de 3 simples com base nos dados da solução de soda cáustica:
-
- A 2ª equação será feita com base na reação de neutralização entre o ácido e a base:
- A 2ª equação será feita com base na reação de neutralização entre o ácido e a base:
-
- Com estes dados monta-se uma 3ª equação, em relação à solução ácida:
- Resposta: 0,045 mol/L.
- Com estes dados monta-se uma 3ª equação, em relação à solução ácida:
Para trabalhos em laboratórios ou indústrias, é importante conhecer as quantidades dos
reagentes que são necessários para produzir determinadas quantidades de produto.
Cálculo estequiométrico é o cálculo das quantidades das substâncias envolvidas numa reação
química, ou seja, aplicar as leis das combinações químicas às reações.
Os cálculos estequiométricos, em princípio, são de dois tipos:
- dada uma determinada quantidade em massa ou volume de um reagente, calcular a
quantidade de um componente do produto da reação química.
- calcular a quantidade de um dos reagentes necessária para produzir determinada quantidade
de produtos através de uma dada reação química.
Podem-se considerar quatro tipos de problemas que envolvem cálculos estequiométricos:
- relação de massa com massa;
- relação de massa com volume;
- relação de volume com volume;
- relação de mol com átomos ou moléculas.
Para facilitar a resolução de problemas que envolvem a estequiometria deve-se seguir
determinada técnica:
1º ) Equaciona-se e ajusta-se a reação química.
2º ) Sublinham-se, na equação química, as substâncias envolvidas nos dados e perguntas do
problema.
3º ) Abaixo das fórmulas, escrevem-se os dados estequiométricos correspondentes às
unidades dos dados (mol, gramas, número de átomos ou moléculas, volume molar).
4º ) Abaixo dos dados estequiométricos, escrevem-se os dados do problema, estabelecendo-se
assim a regra de três.
5º ) Resolve-se a regra de três.
reagentes que são necessários para produzir determinadas quantidades de produto.
Cálculo estequiométrico é o cálculo das quantidades das substâncias envolvidas numa reação
química, ou seja, aplicar as leis das combinações químicas às reações.
Os cálculos estequiométricos, em princípio, são de dois tipos:
- dada uma determinada quantidade em massa ou volume de um reagente, calcular a
quantidade de um componente do produto da reação química.
- calcular a quantidade de um dos reagentes necessária para produzir determinada quantidade
de produtos através de uma dada reação química.
Podem-se considerar quatro tipos de problemas que envolvem cálculos estequiométricos:
- relação de massa com massa;
- relação de massa com volume;
- relação de volume com volume;
- relação de mol com átomos ou moléculas.
Para facilitar a resolução de problemas que envolvem a estequiometria deve-se seguir
determinada técnica:
1º ) Equaciona-se e ajusta-se a reação química.
2º ) Sublinham-se, na equação química, as substâncias envolvidas nos dados e perguntas do
problema.
3º ) Abaixo das fórmulas, escrevem-se os dados estequiométricos correspondentes às
unidades dos dados (mol, gramas, número de átomos ou moléculas, volume molar).
4º ) Abaixo dos dados estequiométricos, escrevem-se os dados do problema, estabelecendo-se
assim a regra de três.
5º ) Resolve-se a regra de três.
2. Grau de Pureza
Os materiais que participam de um processo químico geralmente não são puros. Por isso, em
cálculo estequiométrico, muitas vezes é necessário descontar as impurezas, pois estas não
participarão da reação química. Por exemplo, se trabalhamos com NaCl com 20 % de
impurezas, teremos uma massa total, que corresponde ao sal mais as impurezas que poderiam
ser outras substâncias. Assim, por exemplo, em 60 gramas de cloreto de sódio, temos:
20 % de impurezas = 12 gcálculo estequiométrico, muitas vezes é necessário descontar as impurezas, pois estas não
participarão da reação química. Por exemplo, se trabalhamos com NaCl com 20 % de
impurezas, teremos uma massa total, que corresponde ao sal mais as impurezas que poderiam
ser outras substâncias. Assim, por exemplo, em 60 gramas de cloreto de sódio, temos:
80 % de NaCl puro = 48 g
Massa total = 60 g
2.1. Como se determina estas quantidades (pureza e impureza)?
A massa total (60 g) corresponde a 100%, pois é toda a substância que possui. Estabelece-se,
então, uma regra de três simples para determinar as outras percentagens
Rendimento de uma reação
Rendimento de uma reação
O rendimento de uma reação química está relacionado com vários fatores, tais como:
- Aparelhagem utilizada;
- Deficiência do operador;
- Impureza das substâncias.
- Aparelhagem utilizada;
- Deficiência do operador;
- Impureza das substâncias.
Excesso de reagente
Muitas vezes o enunciado do problema fornece as quantidades de dois reagentes, neste caso,
é necessário verificar se algum dos reagentes está em excesso.Deve-se verificar se estes valores constituem uma proporção, isto é, se obedecem à lei de
Proust. A maneira mais fácil de determinar se a lei de Proust é obedecida ou não é
multiplicando os meios e os extremos. Se estes dois produtos são iguais, estes valores
constituem uma proporção; se forem diferentes, o excesso estará com o reagente que
pertencer ao maior produto.
é necessário verificar se algum dos reagentes está em excesso.Deve-se verificar se estes valores constituem uma proporção, isto é, se obedecem à lei de
Proust. A maneira mais fácil de determinar se a lei de Proust é obedecida ou não é
multiplicando os meios e os extremos. Se estes dois produtos são iguais, estes valores
constituem uma proporção; se forem diferentes, o excesso estará com o reagente que
pertencer ao maior produto.
formula quimica
Uma fórmula química é uma representação de um composto químico. Por exemplo, a fórmula química da água é H2O. A fórmula química sendo uma representação de um composto químico pode nos fornecer algumas informações sobre a substância que ela representa. Por exemplo a fórmula da água H2O. Nesta fórmula aparecem letras e número. As letras representam os elementos químicos que se unem para formar a molécula de água. O número subscrito é chamado de índice e indica a quantidade de átomos do elemento presente em cada molécula. No exemplo da molécula de água, H2O, significa que cada molécula de água é constituída por dois átomos de hidrogénio e 1 átomo de oxigénio. É interessante notar que o número 1 é omitido. Com estudo mais aprofundado sobre Química, a fórmula também nos diz o tipo de ligação química que ocorre entre os átomos formadores da substância, a que tipo de função química a substância pertence. Neste caso a representação H2O é chamada de fórmula molecular.Existem outros tipos de representação:
- Fórmula eletrónica ou de Lewis onde os elétrons da última camada do átomo são representados por pontos (∙) ou “x” ao redor do símbolo do elemento químico. Exemplo:
Repare-se que os elétrons que não estabelecem a ligação química não precisam ser representados.
Existem outros tipos de fórmulas. Tomando por exemplo CH4 Na fórmula molecular temos que colocar a própria fórmula química CH4
Na fórmula eletrónica, deve-se separar os dois componentes, e uni-los no desenho pelos elétrons que eles estão compartilhando
H
·
·
H··C··H
·
·
HNa fórmula estrutural também chamada de fórmula de Couper, deve-se retirar os pontos e colocar "traços"
H
|
H- C -H
|
HMas podem haver ligações PI, e isso significa que pode estar acontecendo uma ligação dupla ou tripla.
ligação covalente
A ligação covalente é um tipo de ligação química caracterizada pelo compartilhamento de um ou mais pares de elétrons entre átomos, causando uma atração mútua entre eles, que mantêm a molécula resultante unida. O nome ligação covalente surgiu em 1939.[1]
Átomos tendem a compartilhar elétrons de modo que suas camadas eletrónicas externas sejam preenchidas e eles adquiram uma distribuição eletrónica mais estável. A força dessas ligações é maior que a das interações intermoleculares e comparável à da ligação iônica. Existem dois tipos principais, a ligação-σ (ligação sigma) e a ligação-π (ligação pi)
Ligações covalentes normalmente ocorrem entre átomos com eletronegatividades similares e altas (geralmente entre dois não-metais), dos quais remover completamente um elétron requer muita energia.
Um tipo especial de ligação covalente é a ligação covalente dativa, também conhecida como ligação covalente coordenada, que ocorre quando um único átomo fornece ambos os elétrons da ligação.
Esse tipo de ligação tende a ser mais forte que outros tipos de ligações, como a iônica. Ao contrário das ligações iônicas, nas quais os íons são mantidos unidos por atração coulômbica não direcional, ligações covalentes são altamente direcionais. Como resultado, Moléculas covalentemente ligadas tendem a formar-se em um número relativamente pequeno de formas características, exibindo ângulos de ligação específicos.
Ordem de ligação
Ordem de ligação é um termo científico usado para descrever o número de pares eletrônicos compartilhados entre os átomos que formam a ligação covalente. O tipo mais comum de ligação covalente é a simples, em que ocorre o compartilhamento de um único par eletrônico entre dois átomos individuais. Aquelas em que mais de um par é compartilhado são chamadas ligações covalentes coordenadas ou simplesmente dativas. O compartilhamento de dois pares é denominado de ligação dupla, e o de três, ligação tripla. Um exemplo de ligação dupla ocorre no ácido nitroso (entre N e O), e um exemplo de ligação tripla ocorre no cianeto de hidrogênio (entre C e N).
Ligações quádruplas estáveis são observadas, normalmente entre dois metais de transição em compostos organometálicos. Ligações de ordem 6 também foram observadas em metais de transição na fase gasosa e são ainda mais raras.
Na ligação covalente normal a diferença de eletronegatividade deve ser menor que 1,7, se essa diferença for maior a ligação é ionica.
Principais Características das ligações e substâncias covalentes e moleculares:
- Sempre que ocorrer ligações covalentes, todos os átomos envolvidos precisam receber eletrons para atingir a estabilidade ou completar sua camada de valência.
- Neste caso ocorrerá com os não-metais e hidrogênio, pois um necessita do outro para atingir sua estabilidade, sendo que o hidrogênio não irá perder seu elétron apenas compartilhar com um elemento o grupo dos não metais por exemplo:o Cl-(Cloro).
- As substâncias moleculares são, em geral, líquidas ou gasosas, entretanto não são boas condutoras de eletricidade, mas as soluções iônicas são boas condutoras de eletricidade.
- As substâncias covalentes, a condições ambiente, isto é a 25°C e 1 atm, podem estar no estado líquido como o éter, sólido como a parafina e no estado gasoso como o gás carbônico. Apresentam baixos pontos de fusao e ebulição, ao contrario das substancias ionicas em que estes são altissímos. As suas macromoléculas apresentam diferenciação formando dessa forma um grande conjunto de átomos, por exemplo: C(grafite) C(diamante), apresentam diferenciação na organização de suas moléculas.
Teorias de ligação covalente
Existem duas teorias que explicam como se formam as ligações covalentes entre átomos. A teoria da ligação de valência e a teoria das orbitais moleculares. Esta última é mais aprofundada, embora a primeira seja suficiente para uma compreensão simplificada da estrutura das moléculas.Ligações múltiplas entre átomos que usam junto 9.453 electrões se chamam monovalentes, 9.454, bivalentes e 9.455, trivalentes.
Usando a mecânica quântica, é possível determinar a estrutura eletrônica, os níveis de energia, ângulos de ligação, comprimentos de ligação, momentos apolares, e espectros de freqüência de moléculas simples com baixo grau de precisão. Atualmente, comprimentos e ângulos de ligações podem ser calculados tão precisamente quanto podem ser medidos (precisão da ordem de poucos picômetros para comprimento e poucos graus para ângulos). Para o caso de pequenas moléculas, cálculos de energia são suficientemente precisos e úteis na determinação de calores de formação e energias de ativação.
Exemplos de ligação covalente
- O2 - cuja fórmula estrutural é O=O
- H2O - cuja fórmula estrutural é H-O-H
Exemplo de ligação covalente coordenada (antiga ligação dativa)
- N2O (óxido nitroso) - um dos nitrogênios faz uma ligação covalente coordenada com o oxigênio.
- É importante lembrar que só acontece uma ligação coordenada se não for mais possível realizar uma ligação covalente molecular. A ligação covalente coordenada é representada por uma flecha (-->).
Ligação química
As ligações químicas são uniões estabelecidas entre átomos para formarem as moléculas, que constituem a estrutura básica de uma substância ou composto. Na Natureza existem aproximadamente uma centena de elementos químicos. Os átomos destes elementos químicos ao se unirem formam a grande diversidade de substâncias químicas.Para exemplificar podemos citar o alfabeto em que podemos juntar as letras para formar as palavras. Os átomos, comparando, seriam as letras e, as moléculas seriam as palavras. Na escrita não podemos simplesmente ir juntando as letras para a formação de palavras: aasc em português não tem significado (salvo se corresponder a uma sigla); porém se organizarmos essas letras teremos casa que já tem o seu significado. Assim como na escrita, a união estabelecida entre átomos não ocorre de qualquer forma, deve haver condições apropriadas para que a ligação entre os átomos ocorra, tais como: afinidade, contato, energia etc. As ligações químicas podem ocorrer através da doação e recepção de elétrons entre os átomos (ligação iônica). Como exemplo NaCl (cloreto de sódio). Compostos iônicos conduzem electricidade no estado líquido ou dissolvido. Eles normalmente têm um alto ponto de fusão e alto ponto de ebulição. Outro tipo de ligações químicas ocorre através do compartilhamento de elétrons: a ligação covalente. Como exemplo H2O (água).
Existe também a ligação metálica onde os elétrons das últimas camadas dos átomos do metal saltam e passam a se movimentar livremente entre os átomos criando uma força de atração entre os átomos do metal, neste caso, não há perda de elétrons.
Teoria do Octeto
Um grande número de elementos adquire estabilidade eletrônica quando seus átomos apresentam oito elétrons na sua camada mais externa. Existem exceções para essa teoria como o Hidrogênio (H) e o Hélio (He), onde ambos se estabilizam com dois elétrons na última camada, ainda temos o caso do átomo de carbono que é tetravalente (pode realizar quatro ligações), além dele todos os átomos que pertencem a família de número 14 da tabela periódica são tetravalentes e sendo assim encontram-se no eixo central dessa regra (Octeto), nesses casos os átomos optam (por assim dizer) por fazer 4 ligações sigma (ligações simples) entre diferentes átomos.Ligações Iônicas ou Eletrovalentes
Ligações Iônicas são um tipo de ligação química baseada na atração eletrostática entre dois íons carregados com cargas opostas. Na formação da ligação iônica, um metal tem uma grande tendência a perder elétron(s), formando um íon positivo ou cátion. Isso ocorre devido à baixa energia de ionização de um metal, isto é, é necessária pouca energia para remover um elétron de um metal. Simultaneamente, o átomo de um ametal (não-metal) possui uma grande tendência a ganhar elétron(s), formando um íon de carga negativa ou ânion. Isso ocorre devido à sua grande afinidade eletrônica. Sendo assim, os dois íons formados, cátion e ânion, se atraem devido a forças eletrostáticas e formam a ligação iônica. Se estes processos estão interligados, ou seja, o(s) elétron(s) perdido(s) pelo metal é(são) ganho(s) pelo ametal, então, seria "como se fosse" que, na ligação iônica, houvesse a formação de íons devido à "transferência" de elétrons do metal para o ametal. Esta analogia simplista é muito utilizada no Ensino Médio, que destaca que a ligação iônica é a única em que ocorre a transferência de elétrons. A regra do octeto pode ser utilizada para explicar de forma simples o que ocorre na ligação iônica. Exemplo: Antes da formação da ligação iônica entre um átomo de sódio e cloro, as camadas eletrônicas se encontram da seguinte forma: 11Na - K = 2; L = 8; M = 1
17Cl - K = 2; L = 8; M = 7 O sódio possui 1 elétron na última camada (camada M). Bastaria perder este elétron para que ele fique "estável" com 8 elétrons na 2ª camada (camada L). O cloro possui 7 elétrons na sua última camada (camada M). É bem mais fácil ele receber 1 elétron e ficar estável do que perder 7 elétrons para ficar estável, sendo isto o que acontece. Sendo assim, é interessante ao sódio doar 1 elétron e ao cloro receber 1 elétron. No esquema abaixo, está representado este processo, onde é mostrado apenas a camada de valência de cada átomo. Seria como se fosse que os átomos se aproximam e ocorre a transferência de elétron do sódio para o cloro:
O resultado final da força de atração entre cátions e ânions é a formação de uma substância sólida, em condições ambientes (25 °C, 1 atm). Não existem moléculas nos sólidos iônicos. Em nível microscópico, a atração entre os íons acaba produzindo aglomerados com formas geométricas bem definidas, denominadas retículos cristalinos. No retículo cristalino cada cátion atrai simultaneamente vários ânions e vice-versa.
Caracteristicas dos compostos ionicos
- Apresentam forma definida, são sólidos nas condições ambientes;
- Possuem altos ponto de fusão e ponto de ebulição;
- Conduzem corrente elétrica quando dissolvidos em água ou fundidos.
Ligações Covalentes ou Moleculares
Ligação covalente ou molecular é aquela onde os átomos possuem a tendência de compartilhar os elétrons de sua camada de valência, ou seja, de sua camada mais instável. Neste tipo de ligação não há a formação de íons, pois as estruturas formadas são eletronicamente neutras, como o exemplo abaixo, do oxigênio. Ele necessita de dois elétrons para ficar estável e o H irá compartilhar seu elétron com o O. Sendo assim o O ainda necessita de um elétron para se estabilizar, então é preciso de mais um H e esse H compartilha seu elétron com o O, estabilizando-o. Sendo assim é formado uma molécula o H2O.
Características dos compostos moleculares.
- Podem ser encontrados nos três estados físicos;
- Apresentam ponto de fusão e ponto de ebulição menores que os compostos iônicos;
- Quando puros, não conduzem eletricidade;
- Quando no estado sólido, podem apresentar dois tipos de retículos cristalinos (R. C. Moleculares, R. C. Covalente).
- Ligações Covalentes Dativa ou Coordenada
Ligação metálica
A ligação metálica ocorre entre metais, isto é, átomos de alta eletropositividade (tendência a doar elétrons).Num sólido, os átomos estão dispostos de maneira variada, mas sempre próximos uns aos outros, compondo um retículo cristalino. Enquanto certos corpos apresentam os elétrons bem presos aos átomos, em outros, algumas dessas partículas permanecem com certa liberdade de se movimentarem no cristal. É o que diferencia, em termos de condutibilidade elétrica, os corpos condutores dos isolantes. Nos corpos condutores, muitos dos elétrons se movimentam livremente no cristal, de forma desordenada, isto é, em todas as direções. E, justamente por ser caótico, esse movimento não resulta em qualquer deslocamento de carga de um lado a outro do cristal.
Aquecendo-se a ponta de uma barra de metal, coloca-se em agitação os átomos que a formam e os que lhe estão próximos. Os elétrons aumentam suas oscilações e a energia se propaga aos átomos mais internos. Neste tipo de cristal os elétrons livres servem de meio de propagação do calor - chocam-se com os átomos mais velozes, aceleram-se e vão aumentar a oscilação dos mais lentos. A possibilidade de melhor condutividade térmica, portanto, depende da presença de elétrons livres no cristal. Estudando-se o fenômeno da condutibilidade elétrica, nota-se que, quando é aplicada uma diferença de potencial, por meio de uma fonte elétrica às paredes de um cristal metálico, os elétrons livres adquirem um movimento ordenado: passam a mover-se do pólo negativo para o pólo positivo, formando um fluxo eletrônico orientado na superfície do metal, pois como se trabalha com cargas de mesmo sinal, estas procuram a maior distância possível entre elas. Quanto mais elétrons livres no condutor, melhor a condução se dá.
Os átomos de um metal têm grande tendência a perder elétrons da última camada e transformar-se em cátions. Esses elétrons, entretanto, são simultaneamente atraídos por outros íons, que então o perdem novamente e assim por diante. Por isso, apesar de predominarem íons positivos e elétrons livres, diz-se que os átomos de um metal são eletricamente neutros.
Os átomos mantêm-se no interior da rede não só por implicações geométricas, mas também por apresentarem um tipo peculiar de ligação química, denominada ligação metálica. A união dos átomos que ocupam os "nós" de uma rede cristalina dá-se por meio dos elétrons de valência que compartilham (os situados em camadas eletrônicas não são completamente cheias). A disposição resultante é a de uma malha formada por íons positivos e uma nuvem eletrônica.
Teoria da nuvem eletrônica
Segundo essa teoria, alguns átomos do metal "perdem" ou "soltam" elétrons de suas últimas camadas; esses elétrons ficam "passeando" entre os átomos dos metais e funcionam como uma "cola" que os mantém unidos. Existe uma força de atração entre os elétrons livres que movimentam-se pelo metal e os cátions fixos.
Propriedade dos metais
- Brilho metálico característico;
- Resistência à tração;
- Condutibilidade elétrica e térmica elevadas;
- Alta densidade;
- Maleabilidade(se deixarem reduzir à chapas e lâminas finas);
- Ductilidade(se deixarem transformar em fios);
- Ponto de fusão elevado;
- Ponto de ebulição elevado.
- referencias:// www.wikipedia enciclopedia.com.br

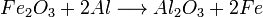




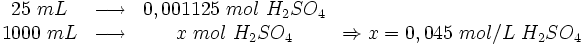

muito bom... tá este conteúdo
ResponderExcluirbrigada meninas.. espero que voces tenham visto as outra postagens.
ResponderExcluire em breve teremos mais...